2022年3月31日,君实生物发布2021年财报,全年营业收入40.25亿元,同比增长152%,净利润-7.21亿,同比去年增长56.8%。
对此,君实生物解释,营业收入尚不能覆盖不断增长的研发费用及其他开支,公司2021年度尚未实现盈利。
君实生物管线中的新冠药物一直颇受关注,虽然君实未公开其中和抗体JS016的业绩贡献,但从礼来近期公布的2021 年业绩情况显示,此款新冠中和抗体为礼来带来 22.39 亿美元收入。而据君实生物年报显示,其新冠口服药VV116已进入国际多中心III期注册临床研究阶段,或成为又一有力的利润增长点。
相比之下,其PD-1抗体特瑞普利单抗的销售额只有4.12亿元,同比锐减58.96%,业内猜测,君实的特瑞普利单抗销售不尽如人意或与其在大适应症的突破速度有关。
PD-1收入锐减或与大适应症突破速度有关
君实的特瑞普利单抗于2018年12月上市,是国内首个获批上市的国产PD-1,具有先发优势,但其2021年销售业绩显然不尽如人意。根据其年报显示,2021年,特瑞普利单抗的全年销售收入仅为4.12亿元,较2020年的销售额10.03亿,下滑幅度达近60%,这也是自其2018年年底获批以来年销售额最低的一年,其上市首年销售业绩为7.78亿。
君实生物在年报中评价PD-1的销售表现时称,2021年销量虽然有所提升,但未能实现“以价换量”,导致销售收入出现负增长。
对于这种情况,君实生物提到多个原因。首先,2020版国家医保目录于2021年3月正式实施后,特瑞普利单抗的产品终端定价相较于2020 年的初始定价降幅超过60%。此外,特瑞普利单抗于报告期末继续纳入2021版国家医保目录并进一步降价后,公司对经销商的全部库存进行了差价补偿,对当期的产品收入确认造成一定影响。
不过业内也猜测,特瑞普利单抗单抗的失利或与其在大适应症上的突破速度有关。
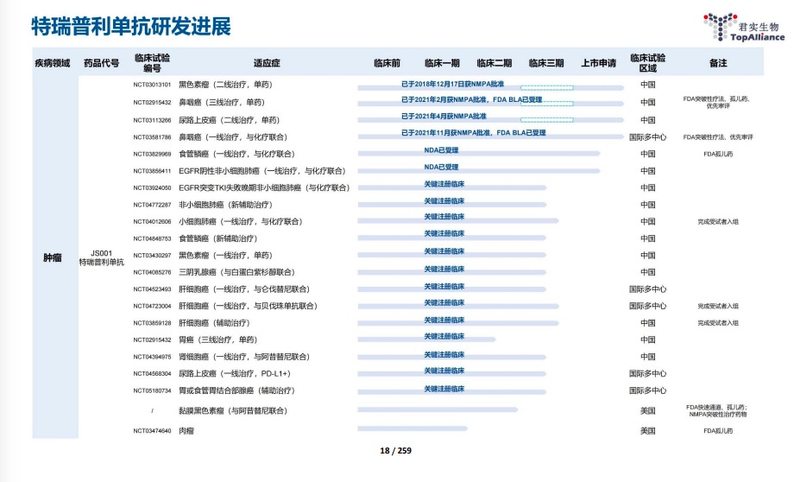
年报显示,特瑞普利单抗在中国获批的适应症仅涵盖黑色素瘤、鼻咽癌、尿路上皮癌。2021年12月,拓益联合标准一线化疗用于未经治疗、驱动基因阴性的晚期非小细胞肺癌的sNDA获得NMPA受理。
CIC灼识咨询咨询总监刘立鹤向蓝鲸财经记者表示,对于已经被纳入医保的四家国产PD-1企业,投资者需要着重针对其医保覆盖适应症进行评估。例如恒瑞医药和百济神州的PD-1产品在2021年医保目录谈判后,均在晚期非小细胞肺癌这一免疫治疗最为重磅最为成熟的适应症以一线治疗进入医保目录,获得了最巨大的潜在市场,而相对应的是,君实的特瑞普利单抗仅在三个中小适应症中以后线治疗进入医保目录,基本失去了在非小细胞肺癌这一兵家必争之地与恒瑞和百济神州竞争的可能。
2021年12月,君实生物收回与阿斯利康制药协议约定的推广权,特瑞普利单抗在中国大陆地区的全部推广活动将由君实商业化团队自主负责。
“在大幅降价的压力下,渠道简化成为必然的趋势。利用外资药企巨头在中国的成熟销售网络进行销售的模式难以适应逐渐压低的终端药价,使得中国本土创新药企业将更加依赖自营销售团队。”刘立鹤说。
押注新冠药物研发
从研报来看,君实生物处于商业化阶段的在研产品共3项(特瑞普利单抗、埃特司韦单抗以及阿达木单抗),23项在研产品处于临床试验阶段(其中昂戈瑞西单抗、VV116、贝伐珠单抗以及PARP抑制剂处于III期临床试验阶段),超过25项在研产品处在临床前开发阶段。在众多产品管线中,君实生物在新冠治疗领域布局4款产品,包括两款中和抗体药JS016、JS026,两款口服药VV116和VV993。
中和抗体方面,君实的埃特司韦单抗(代号JS016/LY-CoV016)是一款重组全人源抗SARS-CoV-2单克隆中和抗体,由君实与中科院微生物所共同开发, 2021年2月,FDA正式批准双抗体疗法的紧急使用授权(以下简称“E UA”)。
年报显示,截至报告期末,此款双抗体疗法已经在全球超过15个国家和地区获得EUA。该抗体的海外权益于2020年5月授权给美国礼来制药。根据协议,礼来向君实生物支付1,000万美元首付款,并在实现规定的里程碑事件后,就JS016向君实生物支付最高2.45亿美元的里程碑款,外加该产品销售净额两位数百分比的销售分成。
此次年报中,君实生物未公开此中和抗体的收益,不过,君实生物的年报显示,随着合作的快速推进,公司关于埃特司韦单抗对Eli Lilly and Company(以下简称“礼来制药”)的海外授权已于报告期内达成双方协议约定的全部里程碑事件。而根据礼来公布的 2021 年业绩情况显示,新冠中和抗体为其带来 22.39 亿美元收入。
不过值得注意的是,1月24日,FDA宣布,礼来/君实中和抗体(etesevimab和bamlanivimab)的使用授权。根据美国疾病控制与预防中心的数据,截至2022年1月15日,美国99%以上的新冠病例都是由omicron突变毒株造成的。而这2款中和抗体对Omicron突变毒株无效,因此FDA决定限制其在美国范围内使用。只有在流行对这些新冠中和抗体敏感突变株的地区,才可以使用。
业内普遍认为,君实生物将下一个增长点寄托到新冠口服药。
目前全世界有大量新冠口服药物在研,我国进展到临床III期的有海正药业(联合富士富山)、开拓药业、君实生物和真实生物,其中只有君实生物的VV116在乌兹别克斯坦得到了紧急使用授权,是国内唯一有使用数据的新冠口服药。
2021年9月,君实生物与旺山旺水达成合作,共同承担VV116在合作区域的临床开发和产业化工作。临床前研究显示,VV116在体内外都表现出显著的抗SARS-CoV-2作用,对SARS-CoV-2原始株和已知重要变异株(Alpha、Beta、Delta和Omicron)均表现出抗病毒活性,同时具有很高的口服生物利用度和良好的化学稳定性。年报显示,VV116已进入国际多中心III期注册临床研究阶段。
VV993君实生物与旺山旺水合作开发的靶向 3CL 蛋白酶的可口服抗新冠病毒候选新药,目前前处于临床前开发阶段。君实生物在年报中指出,VV116 和VV993是针对病毒生命周期的不同关键且保守靶点而开发的药物或候选药物,除了可以单独使用发挥各自的临床优势或特点,还具有“联合用药抗病毒,相得益彰好效果”的发展前景。